







《第二节 碱及其性质PPT课件》是由用户上传到老师板报网,本为文库资料,大小为2.55 MB,总共有24页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 24页
- 2.55 MB
- VIP模板
- ppt
- 数字产品不支持退货
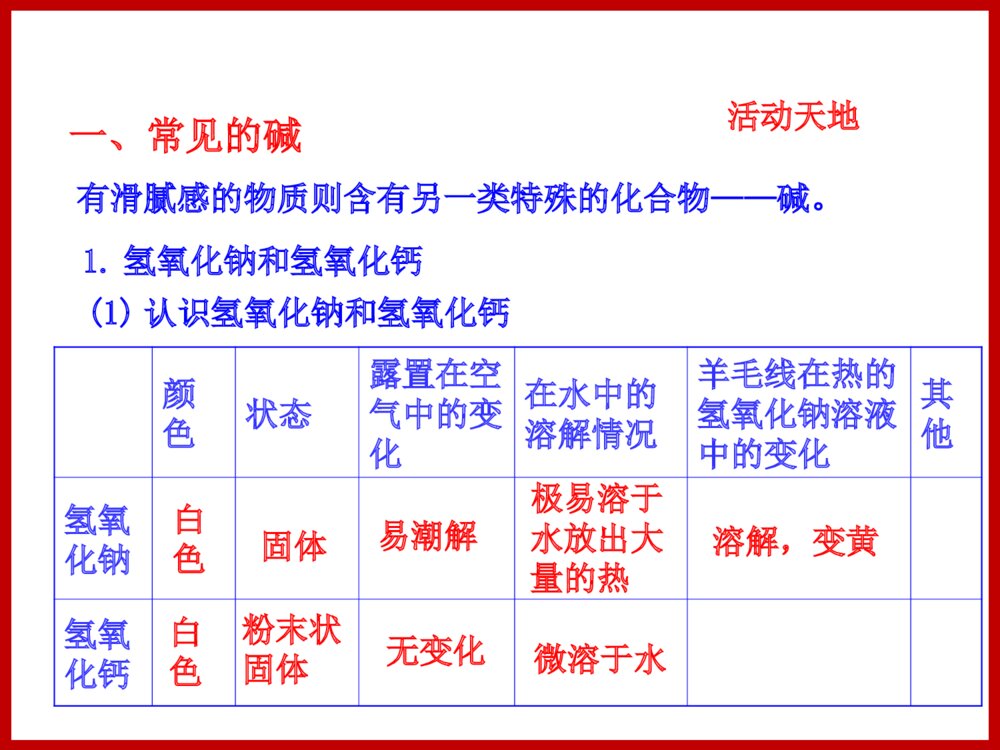
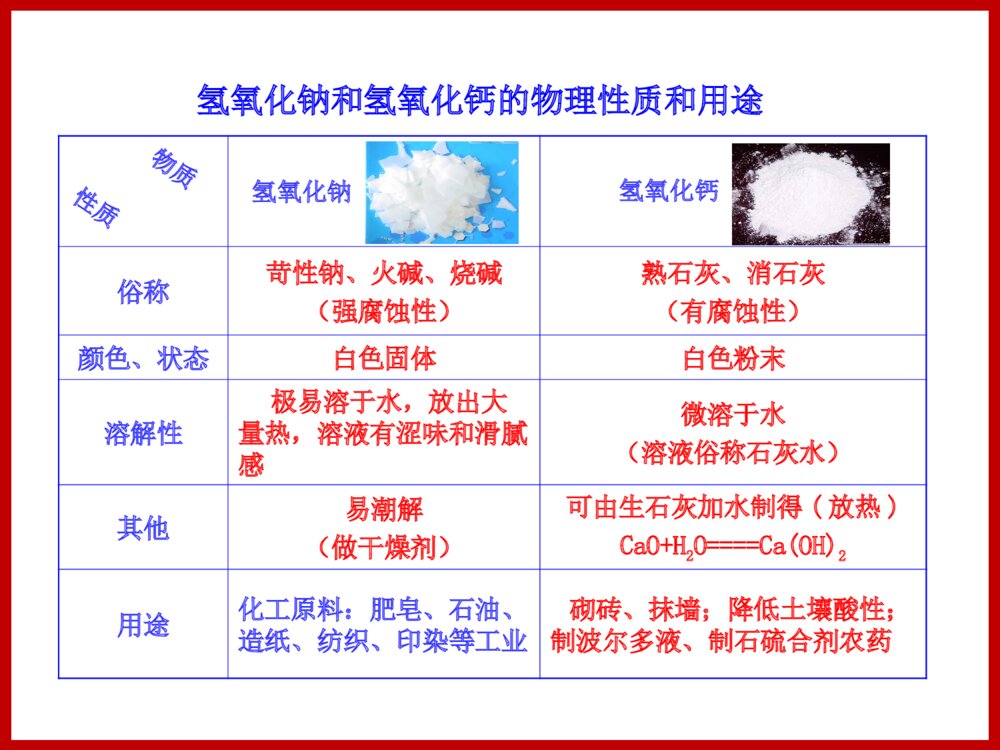
第二节碱及其性质1.认识碱的性质,理解碱的化学性质实质是OH-的性质。2.认识几种重要的碱,掌握使用碱的方法。3.通过对碱的性质的开放性探究活动,引领学生进一步提高科学探究能力。一、常见的碱1.氢氧化钠和氢氧化钙(1)认识氢氧化钠和氢氧化钙活动天地颜色状态露置在空气中的变化在水中的溶解情况羊毛线在热的氢氧化钠溶液中的变化其他氢氧化钠氢氧化钙白色固体粉末状固体白色微溶于水极易溶于水放出大量的热易潮解无变化溶解,变黄有滑腻感的物质则含有另一类特殊的化合物——碱。(3)氢氧化钙[Ca(OH)2](2)氢氧化钠(NaOH)a.俗名:熟石灰、消石灰①暴露在空气中易吸收空气中的水蒸气而溶解,因此应密封保存。②俗称苛性钠、火碱或烧碱,有强烈的腐蚀性。若不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上硼酸溶液。CaO+H2O====Ca(OH)2生石灰熟石灰反应的过程中放出大量的热。b.氢氧化钙的制备工业上通过高温煅烧石灰石生产生石灰:CaCO3====CaO+CO2↑氧化钙俗称生石灰,具有吸水性,常用作干燥剂。除氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]外,常用的碱还有氢氧化钾(KOH)、氢氧化钡[Ba(OH)2]等。ND型气烧石灰窑高温俗称苛性钠、火碱、烧碱(强腐蚀性)熟石灰、消石灰(有腐蚀性)颜色、状态白色固体白色粉末溶解性极易溶于水,放出大量热,溶液有涩味和滑腻感微溶于水(溶液俗称石灰水)其他易潮解(做干燥剂)可由生石灰加水制得(放热)CaO+H2O====Ca(OH)2用途化工原料:肥皂、石油、造纸、纺织、印染等工业砌砖、抹墙;降低土壤酸性;制波尔多液、制石硫合剂农药氢氧化钠和氢氧化钙的物理性质和用途物质性质氢氧化钠氢氧化钙(1)氢氧化钠和氢氧化钙的化学性质的实验探究①在3支试管中分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量氢氧化钠溶液。观察并记录实验现象。②另取3支试管,再分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量澄清石灰水。观察并记录实验现象。完成下列表格。2.碱的化学性质生锈铁钉氯化铜溶液碳酸钠溶液加入氢氧化钠溶液后的现象加入氢氧化钙溶液后的现象无变化无变化蓝色沉淀蓝色沉淀无变化白色沉淀②氢氧化钠和非金属氧化物反应①氢氧化钠和酸碱指示剂反应2NaOH+CO2====Na2CO3+H2O必须密封保存(隔绝水蒸气和二氧化碳)(2)氢氧化钠(NaOH)的化学性质③氢氧化钠和某些盐反应2NaOH+CuSO4====Na2SO4+Cu(OH)2↓3NaOH+FeCl3====3NaCl+Fe(OH)3↓生成蓝色沉淀生成红褐色沉淀②氢氧化钙和非金属氧化物反应③氢氧化钙和某些盐反应①氢氧化钙和酸碱指示剂反应Ca(OH)2+Na2CO3====CaCO3↓+2NaOHCa(OH)2+CO2====CaCO3↓+H2O鉴别二氧化碳气体用石灰砂浆砌砖制造氢氧化钠(3)氢氧化钙Ca(OH)2的化学性质(4)碱的通性由于碱溶液中都有OH-,因此它们具有相似的化学性质。②与某些非金属氧化物反应碱+非金属氧化物→盐+水如:2NaOH+CO2====Na2CO3+H2OCa(OH)2+CO2====CaCO3↓+H2O①与酸碱指示剂的作用紫色石蕊试液遇到碱溶液变蓝色;无色酚酞试液遇到碱溶液变红色。③与某些盐反应碱+盐→新碱+新盐如:CuCl2+2NaOH====2NaCl+Cu(OH)2↓Ca(OH)2+Na2CO3====2NaOH+CaCO3↓3.碱的通性与酸的通性对比b.碱+非金属氧化物→盐+水c.碱+盐→新盐+新碱a.碱溶液能和酸碱指示剂反应酸的通性b.酸+金属→盐+氢气c.酸+金属氧化物→盐+水d.酸+盐→新盐+新酸a.酸溶液能和酸碱指示剂反应碱的通性知识点一、碱的化学性质【典例1】航天员的生命活动和工作能力的必需装备——航天服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是()A.与酸碱指示剂反应B.与二氧化碳反应C.与氧化铁反应D.与氯化铜溶液反应C知识点二、碱的使用、碱的用途等【典例2】下列物质敞口放置在空气中一段时间后,发生质变的是( )A.浓硫酸 B.浓盐酸 C.氢氧化钠溶液 D.氯化钠溶液C1.碱溶液有相似的化学性质的原因是碱溶液中都含有()A.氢离子B.氢氧根离子C.金属离子D.酸根离子B2.下列物质与盐酸反应后所得的溶液中,加入氢氧化钠溶液,能产生红褐色沉淀的是( )A.FeB.Fe2O3C.CuOD.FeOB3.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中的()A.水B.CaCl2溶液C.CO2气体D.澄清石灰水D4.(双选)下列氧化物中,既不和酸反应,又不和碱反应的是()A.CO2B.COC.Fe2O3D.H2OBD5.(双选)下列关于氢氧化钠的描述中错误的是()(提示:牵牛花的变色特点类似紫色石蕊试剂)A.能去除油污,可做炉具的清洁剂B.在空气中能与二氧化碳反应生成碳酸钙C.易溶于水,溶解时放出大量的热D.水溶液能使牵牛花汁液变红BD6.下图广口瓶分别装入下列各组中的气体,滴管分别滴入各组中的液体①氢气、浓硫酸②氮气、苛性钠溶液③氯化氢、水④二氧化碳、烧碱溶液(1)玻璃管下端所系气球能鼓起来的是 (填序号)(2)若发生化学反应,请写出有关的化学方程式:_______________________________aXY③④2NaOH+CO2====Na2CO3+H2O7.“”请结合碱的有关知识,回答下列问题:(1)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥_________________________等气体,氢氧化钙可由生石灰与水反应制得,化学方程式为:。(2)氢氧化钙变质是由于与空气中的________________发生反应的缘故,反应的化学方程式是,因此氢氧化钙应_______保存。H2(符合要求即可)Ca(OH)2+CO2===CaCO3↓+H2O二氧化碳CaO+H2O===Ca(OH)2密封1.常见的碱2.碱的化学性质(1)紫色石蕊试液遇碱溶液变蓝色;无色酚酞试液遇碱溶液变红色。(2)碱+非金属氧化物→盐+水(3)碱+盐→新碱+新盐由于碱溶液中都有OH-,因此它们具有相似的化学性质。涓滴之水终可磨损大石,不是由于它力量大,而是由于昼夜不舍的滴坠。只有勤奋不懈的努力才能够获得那些技巧,因此,我们可以确切地说:不积跬步,无以至千里。——贝多芬



















